仛嫗戝丒嶳拞嫵庼偺尋媶夁掱仌science榑暥仛
偙偺儁乕僕偼嶳拞嫵庼偑弌墘偟偨NHK嫵堢TV乽僒僀僄儞僗丒僛儘乿乮2008擭3寧1擔曻憲乯偱偺偛杮恖偺弎夰偲曬摴帒椏媦傃WIKI儁僨傿傾偺乽iPS嵶朎乿偵娭偡傞婰帠丄science帍側偳傪嶲峫偵偍偄傜偑峔惉偟傑偟偨丅傑偨丄暥拞偵宖嵹偟偨幨恀偼摨斣慻偺僥儗價夋柺傪偍偄傜偑実懷僇儊儔偱嶣塭偟偨傕偺偱偡丅乯
丒偝偰丄乫80擭戙弶傔崰晛捠偵堛妛晹傪弌偰堛巘崙壠帋尡偵崌奿丄椪彴偺惍宍奜壢堛偲偟偰昦堾偵嬑柋偟偨嶳拞巵偱偟偨偑丄椺偊偽儕僂儅僠偺姵幰偵懳偟偰摉帪偼扨偵姵幰偵乽捝傒巭傔乿傪拲幩仌張曽偡傞偲偄偆懳徢椕朄偟偐柍偔丄乽儕僂儅僠偲偄偆昦婥偦偺傕偺偺帯椕乿偼弌棃側偄偺偑尰忬偱偟偨丅偦傟偱傕亀姵幰偼乽捝傒偑寉偔側偭偨乿偲姶幱偟偰偔傟傞偑丄杮摉偼昦婥傪帯偣偰偄傞栿偱偼側偄傫偩亁偲偄偆帺愑偺擮偲椪彴堛乮栜榑丄堛椕偺尰応偱偁傝廳梫側怑庬偱偼偁傞偑乯偲偟偰偺尷奅傪姶偠偨偨傔丄尋媶堛偵揮恑偟傑偟偨丅
丒偲偼偄偊壗偐傜庤傪晅偗偰偄偄偐暘偐傜偢丄亀栤戣偼DNA偵偁傞偺偱偼側偄偐丠亁偲尋媶傪懕偗偨傕偺偺丄拞乆惉壥偑忋偑傜偢丄壗搙傕椪彴堛偵栠傠偆偐偲擸傒傑偟偨偑丄偦偺搙偵亀帺暘偑椪彴堛偲偟偰100恖傗200恖偺姵幰傪帯偣偰傕丄幮夛峷專偲偼巚偊側偐偭偨丅1枩恖扨埵偺僆乕僟乕偱姵幰傪帯偡曽朄傪尒偮偗偹偽堛幰偵側偭偨堄枴偑側偄亁偲帺傜幎欱偟丄寛怱傪嫮傔偰偄偒傑偟偨丅仼栚偺愭偺惉壥偱偼側偔栚昗傪戝偒偔帩偭偨偺偑椙偐偭偨丅丷乮乫乫乯
丒婛偵悽奅偺堛妛奅偱偼乽僋儘乕儞媄弍偺奐敪乿仺乽嵞惗堛椕偺壜擻惈乿偵偮偄偰岅傜傟傞傛偆偵側偭偰偄傑偟偨丅1981擭偵偼willadsen偑僸僣僕偺庴惛棏偐傜僋儘乕儞梤傪嶌偭偰偄偨偐傜偱偡丅嶳拞巵傕偙偺庴惛棏偐傜嵦庢偱偒傞ES嵶朎偺帩偮乽枩擻惈乿偺尞偼DNA偵偁傞偲巚偭偰偄傑偟偨偑妋徹偼帩偰傑偣傫偱偟偨丅
丒偲偙傠偑尋媶傪1擭屻丄嫗搒戝嵞惗堛壢妛尋媶強偺懡揷崅弝嫵庼偵弌夛偄傑偡丅偙偺懡揷弝嫵庼偺尋媶偟偰偄偨偺偑乽懱嵶朎偲ES嵶朎偺梈崌乿偱偟偨丅仼戝懱丄夋婜揑側敪柧丒敪尒傪偡傞恖偵偼乽偙偙偧偲尵偆帪偵椙偄弌夛偄乿偑偁偭偨傝偡傞乮丱_丱乯
丒懡揷弝嫵庼偺尋媶偼師偺傛偆側傕偺偱偡丅
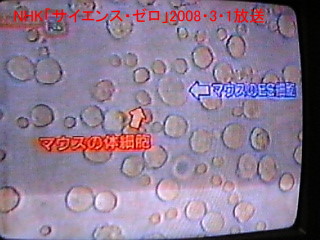 1.傑偢丄攟抧偺擖偭偨僔儍乕儗偺拞偵儅僂僗偺懱嵶朎偲ES嵶朎傪堦弿偵擖傟傞丅偙偺帪揰偱偼懱嵶朎偲ES嵶朎偼僑僠儍僑僠儍偵崿偞傝崌偭偨忬懺偱暿乆偵懚嵼偟偰偄傑偡丅
1.傑偢丄攟抧偺擖偭偨僔儍乕儗偺拞偵儅僂僗偺懱嵶朎偲ES嵶朎傪堦弿偵擖傟傞丅偙偺帪揰偱偼懱嵶朎偲ES嵶朎偼僑僠儍僑僠儍偵崿偞傝崌偭偨忬懺偱暿乆偵懚嵼偟偰偄傑偡丅
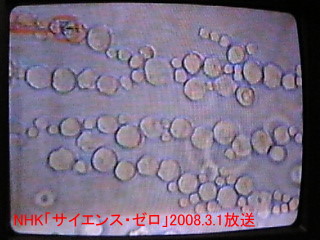 2.偙偺僔儍乕儗偵揹嬌傪晅偗丄揹埑傪偐偗傞偲丄懱嵶朎丒ES嵶朎偑偒傟偄偵楍傪嶌傝傑偡丅
2.偙偺僔儍乕儗偵揹嬌傪晅偗丄揹埑傪偐偗傞偲丄懱嵶朎丒ES嵶朎偑偒傟偄偵楍傪嶌傝傑偡丅
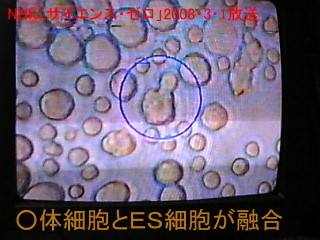 3.峏偵揹棳傪挷愡偡傞偙偲偱丄20暘屻丄椬傝崌偭偨懱嵶朎偲ES嵶朎偑梈崌偟偰1偮偺嵶朎偵側傝傑偟偨丅
3.峏偵揹棳傪挷愡偡傞偙偲偱丄20暘屻丄椬傝崌偭偨懱嵶朎偲ES嵶朎偑梈崌偟偰1偮偺嵶朎偵側傝傑偟偨丅
 4.偙偺乽懱嵶朎偲ES嵶朎傪梈崌偝偣偨嵶朎乿偼丄旂晢嵶朎側傜旂晢偵偟偐暘楐偱偒側偄懱嵶朎偩偭偨偺偵丄乽弶婜壔偝傟偰丄懠偺恎懱偺嵶朎偵傕側傟傞枩擻嵶朎偵栠偭偰偄傞乿偙偲偑暘偐傝傑偟偨丅偮傑傝丄乽ES嵶朎偺DNA偺拞偵丄婛偵暘壔偟偰丄恎懱偺摿掕偺晹暘偵偟偐側傟側偔側偭偰偄傞嵶朎傪儕僙僢僩偡傞亀嵶朎弶婜壔堚揱巕亁偑偁傞偙偲偑暘偐偭偨栿偱偡両乮丳仩丳||
4.偙偺乽懱嵶朎偲ES嵶朎傪梈崌偝偣偨嵶朎乿偼丄旂晢嵶朎側傜旂晢偵偟偐暘楐偱偒側偄懱嵶朎偩偭偨偺偵丄乽弶婜壔偝傟偰丄懠偺恎懱偺嵶朎偵傕側傟傞枩擻嵶朎偵栠偭偰偄傞乿偙偲偑暘偐傝傑偟偨丅偮傑傝丄乽ES嵶朎偺DNA偺拞偵丄婛偵暘壔偟偰丄恎懱偺摿掕偺晹暘偵偟偐側傟側偔側偭偰偄傞嵶朎傪儕僙僢僩偡傞亀嵶朎弶婜壔堚揱巕亁偑偁傞偙偲偑暘偐偭偨栿偱偡両乮丳仩丳||
丒偲偙傠偑丄偙偙偐傜偑戝曄側偙偲偵乮丱丱丟ES嵶朎偑奺慻怐偵暘壔偟偰偟傑偭偨懱嵶朎傪丄尦偺乽怓乆側嵶朎偵側傟傞枩擻嵶朎乿偵弶婜壔乮儕僙僢僩乯偡傞堚揱巕傪帩偭偰偄傞偙偲偑暘偐偭偰傕丄ES嵶朎偵偼悢枩偺堚揱巕偑偁傞栿偱偡丅偦偺拞偐傜丄懱嵶朎傪枩擻壔偡傞堚揱巕傪尒偮偗傞偺偼丄帄擄偺嬈偱偟偨丅偲偙傠偑丄嶳拞嫵庼偵嵞傃儔僢僉乕側弌夛偄偑両両偦傟偑丄乽撈棫峴惌朄恖丒棟壢妛尋媶強僎僲儉壢妛尋媶僙儞僞乕丒椦嶈椙塸億儘僕僃僋僩丒儕乕僟乕乿偱偡丅偙偺椦嶈巵偑傗偭偰偄偨僾儘僕僃僋僩偼丄愼怓懱偺偳偺晹暘偑怱憻偺嵶朎偵側傞乽愝寁恾乿偵側偭偰偄傞偐側偳偺僎僲儉忣曬傪揙掙揑偵挷傋偰僐儞僺儏乕僞乕忋偱僨乕僞儀乕僗壔偡傞嶌嬈傪9擭娫偐偗偰傗偭偰偄偨偺偱偡乮丱_丱乯仼弶傔偰偺偙偲傪惉偟悑偘傞偵偼偙偆偄偆儔僢僉乕傕昁梫偩偲偄偆尒杮丅
偦偺僨乕僞儀乕僗傪棙梡偟偰挷傋偨偲偙傠丄ES嵶朎偺拞偱摥偔僎僲儉乮堚揱巕偺墫婎攝楍乯偑丄偨偭偨3帪娫偱1300屄尒偮偐傝傑偟偨丅 偙偺1300屄偺僎僲儉忣曬傪峏偵3擭娫偐偗偰24屄偵傑偱峣傝崬傒傑偟偨丅偙偺24屄偺僎僲儉傪儗僩儘丒僂僀儖僗偺堚揱巕偵慻傒崬傫偱儅僂僗偺旂晢嵶朎偵姶愼偝偣偰丄嵶朎偺撪晹偵塣偽偣傞栿偱偡偑丄嘆24屄慡晹旂晢嵶朎偵擖傟傞偲枩擻嵶朎偵側偭偨丅嘇1屄偩偗偩偲枩擻嵶朎偵側傜側偐偭偨丅偲偄偆偙偲偑暘偐傝傑偟偨丅偙偺抜奒偱偼24屄偺拞偐傜2屄埲忋偺慻傒崌傢偣傪扵偝側偗傟偽側傜側偄栿偱丄悢妛偺弴楍丒慻傒崌傢偣偺栤戣偲側傝傑偡丅2屄偱偁偭偨応崌偼24亊23亊22亊丅丅2亖偱丄揹戩偱偼寘晄懌偱寁嶼偱偒側偄両両乮丳仩丳||偔傜偄朿戝側慻傒崌傢偣傪幚尡偱帋偟偰傒側偔偰偼側傜側偔側傝傑偟偨丅仼偙偙偱傕嶳拞嫵庼丄傗傗偔偠偗偦偆偵側偭偰偄偨傜偟偄丅乮丱丱丟
偙偺1300屄偺僎僲儉忣曬傪峏偵3擭娫偐偗偰24屄偵傑偱峣傝崬傒傑偟偨丅偙偺24屄偺僎僲儉傪儗僩儘丒僂僀儖僗偺堚揱巕偵慻傒崬傫偱儅僂僗偺旂晢嵶朎偵姶愼偝偣偰丄嵶朎偺撪晹偵塣偽偣傞栿偱偡偑丄嘆24屄慡晹旂晢嵶朎偵擖傟傞偲枩擻嵶朎偵側偭偨丅嘇1屄偩偗偩偲枩擻嵶朎偵側傜側偐偭偨丅偲偄偆偙偲偑暘偐傝傑偟偨丅偙偺抜奒偱偼24屄偺拞偐傜2屄埲忋偺慻傒崌傢偣傪扵偝側偗傟偽側傜側偄栿偱丄悢妛偺弴楍丒慻傒崌傢偣偺栤戣偲側傝傑偡丅2屄偱偁偭偨応崌偼24亊23亊22亊丅丅2亖偱丄揹戩偱偼寘晄懌偱寁嶼偱偒側偄両両乮丳仩丳||偔傜偄朿戝側慻傒崌傢偣傪幚尡偱帋偟偰傒側偔偰偼側傜側偔側傝傑偟偨丅仼偙偙偱傕嶳拞嫵庼丄傗傗偔偠偗偦偆偵側偭偰偄偨傜偟偄丅乮丱丱丟
偦偆偡傞偲丄崱搙偼嶳拞嫵庼偺尋媶僠乕儉偵椙偄傾僀僨傾傪巚偄偮偔儊儞僶乕偑偄傑偟偨丅摉帪偼妛惗偩偭偨丄崅嫶榓棙巵乮尰嫗戝嵞惗堛壢妛尋媶強弝嫵庼乯偱偡丅斵偺傾僀僨傾偼嬌傔偰扨弮側傕偺偱偟偨乽24屄偺僎僲儉偺偆偪1屄偱偼枩擻嵶朎偵弶婜壔偱偒側偄丅偲偄偆偙偲偼丄24屄偺偆偪偐傜1屄偩偗敳偄偨僎僲儉傪旂晢嵶朎偵擖傟偰帋偟偰傒偨傜偳偆偩傠偆丠懱嵶朎偺弶婜壔偵昁梫側僎僲儉側傜1屄寚偗偰傕弶婜壔偱偒側偄偼偢丅偙傟偩偲24夞幚尡偡傟偽丄偳偺僎僲儉偑杮摉偵昁梫側偺偐暘偐傞偺偱偼丠乿敪憐偺揮姺偲偄偆傕偺偺戝愗偝偑暘偐傝傑偡側乣乮丳_丳乯偙偆偟偰丄偐側傝恦懍偵4屄偺僎僲儉乽OCT3/4乿乽SOX2乿乽KLF4乿乽C-MYC乿偑儅僂僗偱摿掕偱偒傑偟偨丅偙傟偑2006擭8寧11擔偵暷壢妛帍乽cell乿偱敪昞偝傟丄悽奅拞偺妛幰傪嬃偐偣傑偟偨丅乮丱_丱乯尰嵼丄敪尒幰偺嶳拞嫵庼偺柤慜傪庢傝乽嶳拞場巕乮Yamanaka factors乯乿偲屇偽傟偰偄傑偡丅
偱丄曗懌偱偡偑丄幚偼儅僂僗偺旂晢嵶朎偵偙傟傜偺僎僲儉傪慻傒崬傫偩儗僩儘丒僂僀儖僗傪姶愼偝偣偰傕丄慡晹偺嵶朎偑姶愼偡傞栿偱偼柍偔丄摉慠乽儕僙僢僩偝傟偰枩擻壔偟偨嵶朎乿偲乽枩擻壔偟側偐偭偨嵶朎乿偑岎偠傝崌偭偰偄傑偡丅偙傟傪乽枩擻壔偟偨嵶朎乿偩偗暘偗側偗傟偽側傝傑偣傫丅偙偺幚尡曽朄榑傕嶳拞嫵庼傜偺僠乕儉偑妋棫偟傑偟偨丅偦偺曽朄偲偼嘆ES嵶朎偺拞偱偟偐堚揱巕偲偟偰偺栶栚傪壥偨偝側偄乮堚揱巕偲偟偰敪尰偟側偄乯偑丄乽枩擻惈乿偲偼柍娭學側乽Fbx15乿偲偄偆僎僲儉偵拝栚嘇乽Fbx15乿偵丄峈惗暔幙乽僱僆儅僀僔儞乿偵懴惈傪帩偨偣傞堚揱巕傪慻傒崬傓嘊嵶朎偺攟抧乮嵶朎傪攟梴偡傞塰梴慺偺擖偭偨塼乯偵丄撆惈偺偁傞乽G418乿乮僱僆儅僀僔儞偲椙偔帡偨峔憿偺峈惗暔幙丒僕僃僱僔僥傿儞乯傪崿偤傞嘋乽僱僆儅僀僔儞懴惈堚揱巕乿偲側偭偨乽Fbx15乿偑摥偔乮敪尰偡傞乯偲乽G418乿偵攟抧偐傜嵶朎偑愙怗偟偰傕柍撆壔偝傟傞嘍枩擻壔偟偰偄側偄懱嵶朎偼乽Fbx15乿偑慻傒崬傑傟偰偄偰傕丄摥偐側偄乮敪尰偟側偄乯偺偱乽G418乿偺撆惈偱巰柵偟偰偟傑偆嘐巆偭偨嵶朎偼乽Fbx15乿偑摥偄偨嵶朎側偺偱丄枩擻嵶朎偱偁傞丅偲偄偆偙偲偑暘偐傝丄傑偨暘棧傕偱偒傞栿偱偡丷乮乫乫乯
偙偆偟偰丄偙傟傜偺儅僂僗偺旂晢嵶朎偐傜嶌傜傟偨枩擻嵶朎傪嶳拞嫵庼偑乽iPS嵶朎乮induced pluripotent stem cell乯乿乮捈栿偼恖岺暘壔枩擻惈嵶朎乯偲柦柤偟傑偟偨丅偙偙傑偱丄尋媶傪巒傔偰偐傜20擭偺嵨寧偑棳傟偰偄偨偺偱偟偨乮丱丱丟仼暔帠丄娙扨偵掹傔偰偼偄偗側偄偲偄偆嫵孭偐側丠
丒偙偺丄乽cell乿帍偵嵹偭偨嶳拞嫵庼偺榑暥偵傛偭偰奺崙乮摿偵暷崙乯偺尋媶幰偑乽iPS嵶朎乿偺嶌惢傪嫞偆傛偆偵側傝傑偟偨丅乮丱_丱乯
1.儅僂僗iPS嵶朎嶌惢朄偺夵椙乮2007擭2寧乯丗乽Fbx15乿堚揱巕偑敪尰偡傞偐偳偆偐傪巜昗乮栚埨乯偲偟偰偄偨嶳拞嫵庼偺摉弶偺嶌惢朄偱嶌傜傟偨乽iPS嵶朎乿偼嵶朎偺宍懺丄憹怋擻椡丄恎懱偺慻怐嵶朎偵暘壔偡傞擻椡偵偮偄偰偼ES嵶朎偲椙偔帡偰偄傑偟偨偑丄堦晹偺堚揱巕敪尰偲DNA儊僠儖壔偺僷僞乕儞偼ES嵶朎偲偼堎側偭偰偄傑偟偨丅偦偙偱嶳拞嫵庼偺僠乕儉偼ES嵶朎偺暘壔枩擻惈偺堐帩偵廳梫側乽Nanog乿堚揱巕偺敪尰傪巜昗偵偟偰乽Oct3/4乿乽Sox2乿乽Klf4乿乽c-Myc乿偺4場巕傪旂晢嵶朎偵擖傟偰乽iPS乿嵶朎傪嶌惢偟偨偲偙傠ES嵶朎偲傎傏尒暘偗偺晅偐側偄枩擻惈傪帩偭偨iPS嵶朎偺嶌惢偵惉岟偟偨丅
2.摨偠崰丄儅僒僠儏乕僙僢僣岺壢戝丒儖僪儖僼丒儎僯僢僔儏傜偺僌儖乕僾傗僴乕僶乕僪姴嵶朎尋媶強偺僐儞儔僢僪丒儂僢働儕儞僈乕傜偺僌儖乕僾丄UCLA堛壢戝僉儍僗儕儞丒僾儔乕僗傜偺僌儖乕僾傕摨條偺曽朄偱丄儅僂僗iPS嵶朎偺庽棫偵惉岟丅
3.偝傜側傞嶌惢朄偺夵椙乮2007擭8寧乯丗儅僒僠儏乕僙僢僣岺壢戝丒儖僪儖僼丒儎僯僢僔儏傜偺僌儖乕僾偑丄iPS摿掕偺巜昗偲側傞堚揱巕偺敪尰傪巊梡偟側偔偰傕丄嵶朎偺宍懺曄壔偺娤嶡偩偗偱iPS嵶朎傪暘棧偱偒傞偙偲傪敪昞丅
4.乮2007擭9寧乯UCLA偺儈僎儖丒僴儅乕儕儑僒儞僩僗傜偺僌儖乕僾傜偑丄儎僯僢僔儏傜偲摨偠嵶朎偺宍懺曄壔偺娤嶡偱iPS嵶朎偵側偭偨偐傪尒暘偗傞曽朄偱丄峏偵乽c-Myc乿乮僈儞堚揱巕偲偄偆柺傕偁傞偺偱栤戣帇偝傟偰偄偨乯傪乽n-Myc乿堚揱巕傪巊偄儗儞僠丒僂僀儖僗傪乽塣傃壆乿偵巊偭偰傕iPS嵶朎偑嶌傟傞偙偲傪敪昞丅
偄傛偄傛乽僸僩iPS嵶朎乿偺嶌惢傊両乮丱_丱乯v
5.乮2007擭11寧20擔乯悽奅偱弶傔偰僸僩ES嵶朎偺嶌惢朄傪敪尒偟偨僕僃乕儉僘丒僩儉僜儞傜偺僌儖乕僾偼丄嶳拞嫵庼傜偺曽朄傪梡偄偰僸僩ES嵶朎偐傜14堚揱巕傪儕僗僩傾僢僾丅偙偺拞偐傜乽Oct3/4乿乽Sox2乿乽Nanog乿乽Lin28乿偺4堚揱巕傪戀帣偺攛桼棃慇堐夎嵶朎傗怴惗帣偺曪旂桼棃慇堐夎嵶朎偵慻傒崬傓偙偲偱丄乽僸僩iPS嵶朎乿偺嶌惢偵惉岟偟偨偲science帍偵敪昞丅
6.乮2007擭11寧20擔乯嶳拞嫵庼傜偺僌儖乕僾傕儅僂僗偺iPS嵶朎嶌惉帪偵巊傢傟偨4堚揱巕乮僸僩偲嫟捠偺堚揱巕偱偁傞偨傔乯傪丄39嵨偺彈惈偺婄偺旂晢慇堐夎嵶朎丄69嵨抝惈偺慇堐夎條妸枌嵶朎丄怴惗帣曪旂桼棃慇堐夎嵶朎偐傜丄乽僸僩iPS嵶朎乿偺嶌惢偵惉岟偟偨偲丄僩儉僜儞傜偲摨偠崋偺science帍偵敪昞丅
7.乮2007擭12寧乯嶳拞嫵庼傜丄儅僂僗偱僈儞堚揱巕偱偁傞乽c-Myc乿堚揱巕傪巊傢側偔偰傕3堚揱巕偱iPS嵶朎偑嶌傟傞偙偲傪敪昞丅儎僯僢僔儏傜偺僌儖乕僾傕摨偠幚尡偵惉岟丅扐偟丄嶌惢偺岠棪偼1/100偵掅壓丅
8.乮2007擭12寧乯僴乕僶乕僪姴嵶朎尋媶強偺僕儑乕僕丒僨僀儕乕傜偺僌儖乕僾偑嶳拞嫵庼傜偺4堚揱巕偵壛偊丄乽hTERT乿乽SV40丒lsrge T乿偺6堚揱巕偱乽僸僩iPS嵶朎乿傪嶌惢偟偨偲敪昞丅僩儉僜儞傜傗嶳拞嫵庼傜偼乽幚尡梡偵斕攧偝傟偰偄傞僸僩偺旂晢嵶朎傪攟梴偟偨嵶朎乿傪巊偭偰偄傞偺偵懳偟偰丄乽惉恖抝惈偺庤偺傂傜偐傜捈愙嵦庢偟偨旂晢嵶朎乿傪巊偭偰偄傞揰偱乽嵞惗堛椕偺幚尰乿偵堦曕嬤偯偄偨偲尵偊傑偡丅
9.乮2007擭12寧乯儃僗僩儞丒儂儚僀僩僿僢僪尋媶強僕僃僀僐僽丒僴儞僫傜偼丄乽愒寣媴偺堎忢偵傛傞昻寣乿偺帯椕偺儅僂僗幚尡偵丄儅僂僗偱嶌惢偟偨iPS嵶朎偵惓忢側愒寣媴傪嶌傞僎僲儉傪慻擖傟攟梴仺儅僂僗偵拲幩偟偨傜帯椕偱偒偨偙偲傪曬崘丅
10.乮2007擭12寧乯MIT偺儎僯僢僔儏傜丄乽僸僩偺姍忬愒寣媴昻寣徢堚揱巕乮堎忢側愒寣媴傪嶌偭偰偟傑偆堚揱巕乯乿傪慻傒崬傫偩儅僂僗偺怟旜偐傜iPS嵶朎傪嶌惢仺偙偺堚揱巕堎忢傪堚揱巕慻傒姺偊偵傛偭偰惓忢宆偵曄偊傞仺憿寣姴嵶朎乮寣塼偺惉暘傪嶌傞嵶朎乯偵暘壔偝偣傞仺曻幩慄傪徠幩偟偰丄堎忢側愒寣媴傪嶌傞偙偺儅僂僗偺憿寣姴嵶朎傪夡偡仺儅僂僗偵愭傎偳偺惓忢壔偝偣偨iPS嵶朎傪堏怉偟偰儅僂僗傪夞暅偝偣丄嫅愨斀墳傕婲傜側偐偭偨丄偲敪昞丅
11.傑偨丄僇儕僼僅儖僯傾丒僗僋儕僾僗尋媶強偺僔僃儞僨傿儞僌攷巑偼丄嶳拞嫵庼傜偺尋媶傪嶲峫偵傑偭偨偔堘偭偨傾僾儘乕僠傪偟偰偄傑偡丅斵傜偺曽朄偼懱嵶朎偺奜偐傜4偮偺僎僲儉傪擖傟傞偺偱偼柍偔丄懱嵶朎偵壔妛暔幙傪擖傟偰亀懱嵶朎偺弶婜壔亁偑偱偒側偄偐丠傪尋媶拞偱丄偁傞壔妛暔幙乮旈枾傜偟偄乯傪擖傟傞偲丄嶳拞嫵庼傜偺4偮偺僎僲儉傪2偮偵尭傜偟偰傕丄iPS嵶朎偵側傞偙偲傪撍偒巭傔傑偟偨丅尰嵼偼丄悢10枩庬椶偺壔妛暔幙傪峣傝崬傓嶌嬈傪懕偗偰偄傑偡丅乮丱v丱乯
偙偺傛偆偵丄崱傑偱偺僸僩偺庴惛棏傪巊偆偲偄偆ES嵶朎偵傛傞嵞惗堛椕仌僋儘乕儞偺尋媶偼恖娫偵惉挿偡傞壜擻惈偺偁傞棏巕傪巊偆偲偄偆揰偱摿偵僉儕僗僩嫵搆偐傜偺嫮偄斸敾傕偁偭偨栿偱偡偑丄偙偺iPS嵶朎偺奐敪偵傛偭偰儘乕儅朄墹挕傕乽擄昦帯椕偵宷偑傞媄弍傪丄庴惛棏傪攋夡偡傞夁掱宱偢偵峴偊傞偙偲偵側偭偨偙偲傪徿巀偡傞乿偲偺敪昞傪偟丄傑偨僉儕僗僩嫵揑椣棟娤偐傜ES嵶朎傪巊偭偨嵞惗堛椕偺尋媶偵斸敾揑偱丄乽憻婍堏怉悇恑攈乿偩偭偨僕儑乕僕丒僽僢僔儏暷戝摑椞傕乽偙傟偱丄椣棟揑栤戣偼柍偔側偭偨乿偲愨巀偟偰偄傑偡丅乮丱_丱乯
偟偐偟丄尰幚偵偼傑偩嵶朎儗儀儖偺婎慴尋媶偱偁傝丄崅搙側婡擻傪帩偭偨慻怐傗憻婍傪嶌傟傞抜奒偱偼偁傝傑偣傫丅偨偩丄崱傑偱偼乽懠恖偑巰偸偺傪懸偭偰丄嫅愨斀墳偑偁傞偐傕抦傟側偄丄偦偺憻婍傪堏怉偡傞偟偐柍偐偭偨昦婥偵娭偟偰丄暷崙偱偼偁傑傝掞峈姶偑柍偄傛偆偱偡偑丄偍偄傜偺擔杮恖揑姶妎偱偼乽帺暘偑惗偒傞偨傔偵丄懠恖偺巰傪懸偨偹偽側傜側偄偺偐丠乿偲偄偆掞峈姶偑憻婍堏怉偵偼偁傝傑偟偨偑乮柍榑姵幰丒僪僫乕嫟偵妺摗偼偁傞偲巚偆偑乯丄彮側偔偲傕彨棃揑偵偼乽姵幰帺恎偺旂晢嵶朎偐傜懯栚偵側偭偨慻怐傗撪憻傪嶌傞偙偲偑偱偒傞偐傕抦傟側偄乿偲偄偆婓朷偑惗傑傟偨偲偄偆揰偱夋婜揑側敪柧偩偲巚偄傑偡丅丷乮乫乫乯
丒儊儕僢僩丗1.怱憻傗擼偼惗偒偰偄傞姵幰偺嵶朎乮怱嬝姴嵶朎丒恄宱姴嵶朎乯傪庢傝弌偟偰丄姵幰偺堚揱巕偺偳偙偵栤戣偑偁偭偰昦婥偑婲偒偨偺偐挷傋傜傟側偐偭偨偑丄旂晢嵶朎偐傜iPS嵶朎傪嶌傝怱嬝傗恄宱偵暘壔偝偣偰傒傟偽丄偙偺栤戣揰偑挷傋傜傟傞丅
2.姵幰偺DNA偵偁偭偨栻傪慖傋傞丅
3.乽摿掕偺姵幰偵偁傞栻偑偳偆偄偆暃嶌梡偑弌傞偐乿乮姵幰偲栻偲偺憡惈乯傪恖懱幚尡傪偟側偔偰傕梊應偱偒傞丅
丒僨儊儕僢僩1.僈儞堚揱巕偱偁傞乽c-Myc乿堚揱巕傪巊偭偰偄傞偨傔丄20亾偲偄偆崅偄妋棪偱僈儞偑敪惗偡傞壜擻惈偑偁傞偙偲丅仺偦偺屻乽c-Myc乿僎僲儉傪巊傢側偔偰傕3偮偺堚揱巕偱傕iPS嵶朎傪嶌傟傞傛偆偵偱偒偨偑丄岠棪偼1/100偵棊偪傞乮偦偺屻1/25傑偱岦忋偟偨乯偙偲丅
3.僈儞堚揱巕傪巊傢側偄傛偆偵偟偰傕丄嶳拞嫵庼偺乽僂僀儖僗偵慻傒崬傫偱懱嵶朎偺妀偵乽弶婜壔堚揱巕乿傪塣傇偲偄偆曽朄偩偲丄僂僀儖僗偺拞偵慻傒崬傑傟偨乽弶婜壔堚揱巕乿偑丄懱嵶朎偺偳偺晹暘偺愼怓懱偵慻傒崬傑傟傞偐梊應偱偒側偄偨傔丄偄偢傟偵偣傛慻傒崬傑傟偨旂晢嵶朎偑僈儞壔偡傞壜擻惈偼斲掕偱偒側偄偙偲丅
4.偦偆偟偨堄枴偱偼丄僔僃儞僨傿儞僌攷巑偺乽壔妛暔幙傪巊偭偨曽朄乿偺曽偑埨慡偱偼側偄偐丠仺偙偺暘栰偱偼暷崙偺曽偑尋媶偑恑傫偱偄傞丅
5.尰嵼偺偲偙傠丄iPS嵶朎傕娷傔偨乽枩擻嵶朎乿帺懱偑恄宱嵶朎傗嬝嵶朎偵偼側傝傗偡偄偑丄娞嵶朎偺傛偆側暋嶨側慻怐偵偼側傝偯傜偄丅
6.旂晢偐傜惛巕仌棏巕偑嶌傟偰偟傑偆偺偱丄ES嵶朎傛傝娙扨偵僋儘乕儞恖娫偑嶌傟偰偟傑偆偐傕丠偲偄偆椣棟忋偺栤戣揰偼柍偔側偭偰偄側偄偙偲丅
7.尰嵼丄擔暷偱寖偟偄尋媶嫞憟偑懕偄偰偄傞偑丄偙偺媄弍偵傛偭偰乽嵞惗堛椕媄弍偺妋棫乿偑弌棃偨傎偆偑摿嫋傪庢傟傞仺摿嫋傪庢傟側偐偭偨崙偺嵞惗堛椕旓偑崅偔側傞丅偲偄偆栤戣揰傕丅乮埲慜丄擔杮偼僎僲儉尋媶忣曬傪乽恖椶嫟捠偺嵿嶻乿偲偟偰柍椏岞奐偟偰偄偨傜丄暷崙偺illumina幮偵偦偺忣曬傪傑傞傑傞摿嫋傪庢傜傟偰偟傑偭偨偲偄偆嬯偄宱尡偑偁傞乯
側偳偑嫇偘傜傟偰偄傑偡丷乮乫乫乯偲偙傠偱丄廬棃乽尋媶幒乿偲偄偆傕偺偼暵嵔揑偱懠偺尋媶傪偟偰偄傞尋媶幒偲偼暻偱妘偰傜傟偰偍傝丄摨偠戝妛偱傕懠偺尋媶幒偱偳傫側曽朄偱尋媶傪偟偰偄傞偐丄暘偐傜側偄忬懺偱偟偨丅偙偺傗傝曽偱偼尋媶偺僗僺乕僪偑抶偔丄偲偰傕暷崙偵偼乮梊嶼柺傕娷傔偰乯彑偰傑偣傫両偱丄嶳拞嫵庼偼帺恎傕尋媶僗儁乕僗傪帩偭偰偄傞僇儕僼僅儖僯傾丒僌儔僢僪僗僩乕儞怱憻幘姵尋媶強偺傗傝曽傪嶲峫偵偟傑偟偨丅摨尋媶強偼奺尋媶幒丒僠乕儉偛偲偵暻偱妘偰偰偍傜偢丄戝偒側儚儞僼儘傾偵偦傟偧傟偺尋媶僠乕儉偺僽乕僗乮偲偄偆傛傝幚尡婍嬶傪抲偔婘偲扞偑偄偔偮傕杮扞偺傛偆偵暲傫偱偄傞偩偗乯偑偁傝丄偁傞暘栰偺尋媶偵峴偒媗偭偨尋媶幰偑惡傪忋偘傞偲丄懠偺尋媶幰傕傾僀僨傾傪弌偡偺偵嫤椡偟偰偔傟傞懱惂偵側偭偰偄偰丄尋媶惉壥傪偩偡僗僺乕僪偑奿抜偵憗偄偺偱偡丅乮擔杮偱敿擭偐偐傞尋媶偑1廡娫偱偱偒傞偔傜偄乯崱屻丄偙偺暘栰偱擔杮偑儕乕僪偟偰偄偔偨傔偵偼尋媶偺惉壥傪弌偡僗僺乕僪傪憗傔傞昁梫偑偁傝傑偡丅乮尰嵼丄偙偆偟偨嵞惗堛椕傗擼尋媶偱偼擔杮偺尋媶幰偼傾儊儕僇偺悢10暘偺1掱搙偺梊嶼偱摨偠偔傜偄偺惉壥傪嫇偘偰偍傝丄儗儀儖揑偵傕崱偑僺乕僋偱偼側偄偐偲尵傢傟偰偄傞乯偦偙偱丄暥晹壢妛徣偵懳偟偰嶳拞嫵庼偼乽擔杮偺桳擻側尋媶幰傪堦売強偵廤傔偰崌廻忬懺偵偟偨偄乿偲梫朷偟丄2008擭1寧丄嫗戝偵乽iPS嵶朎尋媶僙儞僞乕丒僠乕儉僕儍僷儞乿偑嶳拞嫵庼傪僙儞僞乕挿偵偟偰抋惗偟傑偟偨丅乮丱倴丱乯倴崱屻偺尋媶惉壥偑妝偟傒偱偁傝傑偡丅
 1.傑偢丄攟抧偺擖偭偨僔儍乕儗偺拞偵儅僂僗偺懱嵶朎偲ES嵶朎傪堦弿偵擖傟傞丅偙偺帪揰偱偼懱嵶朎偲ES嵶朎偼僑僠儍僑僠儍偵崿偞傝崌偭偨忬懺偱暿乆偵懚嵼偟偰偄傑偡丅
1.傑偢丄攟抧偺擖偭偨僔儍乕儗偺拞偵儅僂僗偺懱嵶朎偲ES嵶朎傪堦弿偵擖傟傞丅偙偺帪揰偱偼懱嵶朎偲ES嵶朎偼僑僠儍僑僠儍偵崿偞傝崌偭偨忬懺偱暿乆偵懚嵼偟偰偄傑偡丅 2.偙偺僔儍乕儗偵揹嬌傪晅偗丄揹埑傪偐偗傞偲丄懱嵶朎丒ES嵶朎偑偒傟偄偵楍傪嶌傝傑偡丅
2.偙偺僔儍乕儗偵揹嬌傪晅偗丄揹埑傪偐偗傞偲丄懱嵶朎丒ES嵶朎偑偒傟偄偵楍傪嶌傝傑偡丅 3.峏偵揹棳傪挷愡偡傞偙偲偱丄20暘屻丄椬傝崌偭偨懱嵶朎偲ES嵶朎偑梈崌偟偰1偮偺嵶朎偵側傝傑偟偨丅
3.峏偵揹棳傪挷愡偡傞偙偲偱丄20暘屻丄椬傝崌偭偨懱嵶朎偲ES嵶朎偑梈崌偟偰1偮偺嵶朎偵側傝傑偟偨丅 4.偙偺乽懱嵶朎偲ES嵶朎傪梈崌偝偣偨嵶朎乿偼丄旂晢嵶朎側傜旂晢偵偟偐暘楐偱偒側偄懱嵶朎偩偭偨偺偵丄乽弶婜壔偝傟偰丄懠偺恎懱偺嵶朎偵傕側傟傞枩擻嵶朎偵栠偭偰偄傞乿偙偲偑暘偐傝傑偟偨丅偮傑傝丄乽ES嵶朎偺DNA偺拞偵丄婛偵暘壔偟偰丄恎懱偺摿掕偺晹暘偵偟偐側傟側偔側偭偰偄傞嵶朎傪儕僙僢僩偡傞亀嵶朎弶婜壔堚揱巕亁偑偁傞偙偲偑暘偐偭偨栿偱偡両乮丳仩丳||
4.偙偺乽懱嵶朎偲ES嵶朎傪梈崌偝偣偨嵶朎乿偼丄旂晢嵶朎側傜旂晢偵偟偐暘楐偱偒側偄懱嵶朎偩偭偨偺偵丄乽弶婜壔偝傟偰丄懠偺恎懱偺嵶朎偵傕側傟傞枩擻嵶朎偵栠偭偰偄傞乿偙偲偑暘偐傝傑偟偨丅偮傑傝丄乽ES嵶朎偺DNA偺拞偵丄婛偵暘壔偟偰丄恎懱偺摿掕偺晹暘偵偟偐側傟側偔側偭偰偄傞嵶朎傪儕僙僢僩偡傞亀嵶朎弶婜壔堚揱巕亁偑偁傞偙偲偑暘偐偭偨栿偱偡両乮丳仩丳|| 偙偺1300屄偺僎僲儉忣曬傪峏偵3擭娫偐偗偰24屄偵傑偱峣傝崬傒傑偟偨丅偙偺24屄偺僎僲儉傪儗僩儘丒僂僀儖僗偺堚揱巕偵慻傒崬傫偱儅僂僗偺旂晢嵶朎偵姶愼偝偣偰丄嵶朎偺撪晹偵塣偽偣傞栿偱偡偑丄嘆24屄慡晹旂晢嵶朎偵擖傟傞偲枩擻嵶朎偵側偭偨丅嘇1屄偩偗偩偲枩擻嵶朎偵側傜側偐偭偨丅偲偄偆偙偲偑暘偐傝傑偟偨丅偙偺抜奒偱偼24屄偺拞偐傜2屄埲忋偺慻傒崌傢偣傪扵偝側偗傟偽側傜側偄栿偱丄悢妛偺弴楍丒慻傒崌傢偣偺栤戣偲側傝傑偡丅2屄偱偁偭偨応崌偼24亊23亊22亊丅丅2亖偱丄揹戩偱偼寘晄懌偱寁嶼偱偒側偄両両乮丳仩丳||偔傜偄朿戝側慻傒崌傢偣傪幚尡偱帋偟偰傒側偔偰偼側傜側偔側傝傑偟偨丅仼偙偙偱傕嶳拞嫵庼丄傗傗偔偠偗偦偆偵側偭偰偄偨傜偟偄丅乮丱丱丟
偙偺1300屄偺僎僲儉忣曬傪峏偵3擭娫偐偗偰24屄偵傑偱峣傝崬傒傑偟偨丅偙偺24屄偺僎僲儉傪儗僩儘丒僂僀儖僗偺堚揱巕偵慻傒崬傫偱儅僂僗偺旂晢嵶朎偵姶愼偝偣偰丄嵶朎偺撪晹偵塣偽偣傞栿偱偡偑丄嘆24屄慡晹旂晢嵶朎偵擖傟傞偲枩擻嵶朎偵側偭偨丅嘇1屄偩偗偩偲枩擻嵶朎偵側傜側偐偭偨丅偲偄偆偙偲偑暘偐傝傑偟偨丅偙偺抜奒偱偼24屄偺拞偐傜2屄埲忋偺慻傒崌傢偣傪扵偝側偗傟偽側傜側偄栿偱丄悢妛偺弴楍丒慻傒崌傢偣偺栤戣偲側傝傑偡丅2屄偱偁偭偨応崌偼24亊23亊22亊丅丅2亖偱丄揹戩偱偼寘晄懌偱寁嶼偱偒側偄両両乮丳仩丳||偔傜偄朿戝側慻傒崌傢偣傪幚尡偱帋偟偰傒側偔偰偼側傜側偔側傝傑偟偨丅仼偙偙偱傕嶳拞嫵庼丄傗傗偔偠偗偦偆偵側偭偰偄偨傜偟偄丅乮丱丱丟