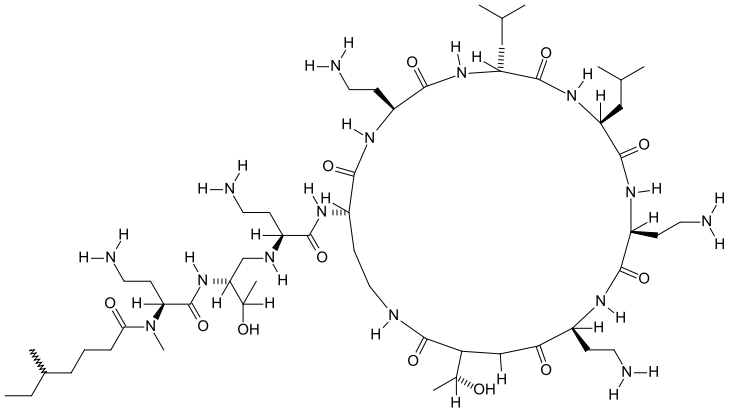
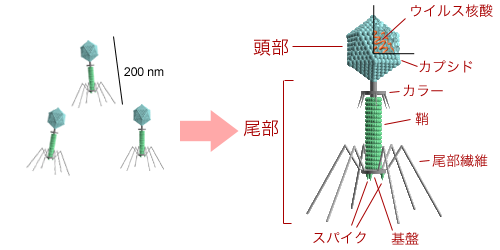
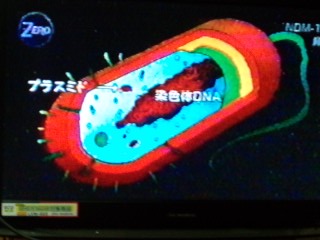
 (NHK教育・サイエンスゼロ放送の図をおいらがテレビの画面を写真に撮ったもの)
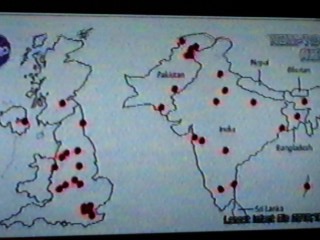
(NHK教育・サイエンスゼロ放送の図をおいらがテレビの画面を写真に撮ったもの) (国立感染症研究所資料より転載)
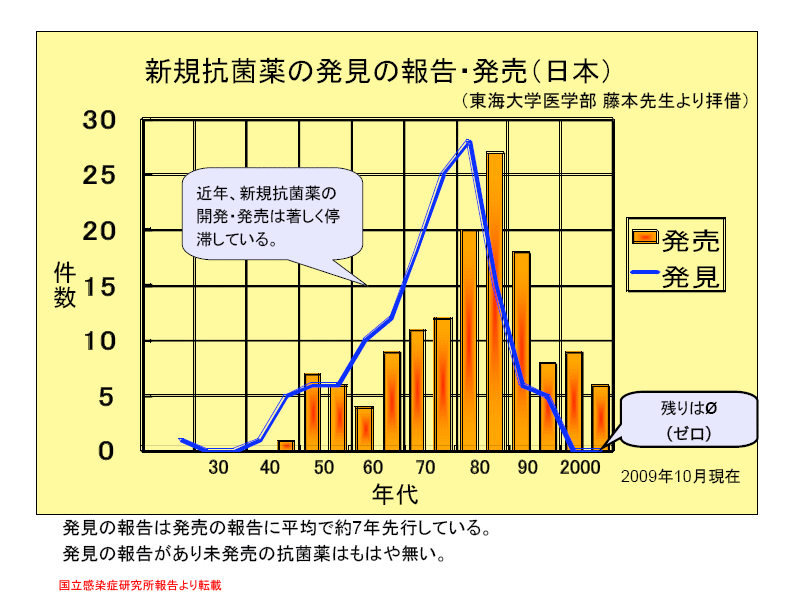
(国立感染症研究所資料より転載)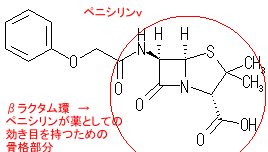 ⇒
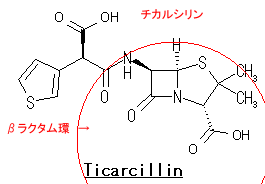
⇒


|
グラム陰性桿菌の中にはこんな危険な”人食いバクテリア”も!! ・下のQ&Aはテレビで”恐怖の人食いバクテリア”とかいう特集をやっていたときに、気になって国立感染症研究所のHPで調べたものです。何故、テレビで”人食いバクテリア”と呼んだかというと、感染した人の細胞をまさに”餌”として食べてしまうからです。 Q.ビブリオ・バルニフィカスとは? 腸炎ビブリオやコレラ菌などと同じビブリオ科に属し、腸炎ビブリオ(Vibrio parahaemolyticus)と性状などで共通点も多いグラム陰性桿菌です。ビブリオ・バルニフィカス(V. vulnificus)の名前はこの菌が創傷(wound=vulnus)を起こすことに由来しています。 主に暖かい海水中の甲殻類や魚介類の表面や動物性プランクトンなどに付着しつつ増殖し、周囲の海水中にも遊出します。2〜3%の塩分濃度で良く増殖し、汚染された魚介類の摂取や皮膚の創傷などから人に感染します。 Q.どのような症状をおこし、どのくらいの症例があるか教えてください 健常者では下痢や腹痛を起こすこともありますが、重症になることはほとんどありません。しかし、免疫力の低下している人や特に肝硬変などの重大な肝臓疾患のある人なとでは注意が必要となります。また、治療のために鉄剤の投与を受けている貧血患者も注意が必要という指摘もあります(医系微生物学:朝倉書店、初版本p.211)。肝臓でのクリアランスの低下や、血清鉄が細菌の病原性や増殖性を増すことなどから、細菌が血液中に侵入し、数時間から1日の潜伏期の後、峰巣炎等の皮膚病変の拡大や、発熱、悪寒、血圧の低下などの敗血症様症状を起こし、生命を脅かすことがあります。この細菌が血行性に全身性感染をおこした場合、致死率は50〜70%と非常に高くなります。 米国ではメキシコ湾沿岸の州を中心に1988年から1995年までに300例以上の報告があります。国内でも現在までに分かっているだけでも100例以上が報告されています。 Q. 治療・予防方法を教えてください 治療は補液や抗菌薬による治療が中心となります。米国ではドキシサイクリンや第3世代セフェム薬剤が使用されます。国内でも、同様に第3世代セフェム薬剤やテトラサイクリンなどで胆汁排泄型の薬剤が効果があると言われていますが、病状が進行してからの投与は無効です。ハイリスクの人が生鮮魚介類を生食後、体調に不調を感じたら直ちに医療機関にかかることが重要です。 我が国では刺身や寿司等の材料となる多くの魚介類の摂取が原因となっていますので、肝臓障害をもつ当疾患に対するリスクの高い人は、生の魚介類を控えた方が良いでしょう。一方、欧米での原因の多くは、生牡蠣の摂取です。 予防方法としては、肝臓障害をもつ当疾患に対するリスクの高い人は、夏季に生牡蠣や十分調理されていない魚および貝類を食べないようにする。貝を煮るときには貝が開いてからも5分間、蒸す場合には9分間以上の調理を行う。開かない貝は食べないようにする。むき身の牡蠣は3分間以上ゆでるか、191℃で10分間以上油で焼く。調理済みの食品が他の生の魚介類からの汚染を防ぐ(まな板など)ようにする。調理したらすぐに食べるなどの点に注意が必要です。 創傷があるときは暖かい海水や汚れた水が、傷に付着するのを防ぐなどの防御法をとることが必要となります。海岸や岩場で裸足で歩いて貝の殻などで怪我をし感染したと思われる事例も過去にありますので、ハイリスクの人は海岸での素足歩きは禁物です。 (国立感染症研究所 感染症情報センター・細菌部・細菌血液製剤部) |
|
NDM-1およびNDM-1産生菌の特徴 1.NDM-1はβラクタム剤を分解するβラクタマーゼの1つです。 細菌はβラクタム剤を分解する酵素(βラクタマーゼ)を産生することにより本剤に対して耐性を獲得します。そのβラクタマーゼには多数の種類が知られていますが、この中でNDM-1はクラスBβラクタマーゼ(メタロβラクタマーゼ)に分類されるものの1つです。本酵素のもっとも重要な特徴は、ペニシリン・セフェム剤からカルバペネム剤まで全てのβラクタム剤を分解する、すなわちβラクタム剤全てに耐性をもたらす耐性因子であることです。 2.インド・パキスタン・バングラデシュなどでNDM-1産生菌の出現が報告されています。 NDM-1を産生する菌は、2009年にインドから帰国したスェーデン人からはじめて分離されました(Antimicrob Agents Chemother 53:5046-54, 2009)。その後の報告で、インドやパキスタン・バングラデッシュにおいてNDM-1産生菌が蔓延している可能性が指摘されています(Lancet Infect Dis 10:597-602, 2010)。NDM-1の名前の由来は、“ニューデリーで分離されたメタロβラクタマーゼ(New Delhi metallo-β-lactamase)”からきています。インドに旅行した人が持ち込んだと思われるNDM-1産生菌がイギリス国内で拡散し、大きな社会問題として取り上げられています。この他、米国、オーストラリア、カナダ、ベルギーなどでも相次いで分離が報告され世界的な問題として認識されつつあります。 3.NDM-1と同じクラスのβラクタマーゼを産生する菌はすでに日本で多数報告されています。 前述したようにNDM-1はメタロβラクタマーゼの1つです。実はこのメタロβラクタマーゼを産生する菌はこれまでに本邦においても多数報告されていました。もっとも多く報告されているメタロβラクタマーゼ産生菌は緑膿菌とアシネトバクターであり、特に多剤耐性緑膿菌においてはその70%がメタロβラクタマーゼ産生との報告もみられます。ただし、緑膿菌が保有するメタロβラクタマーゼはIMP型あるいはVIM型と呼ばれるもので、今回問題となっているNDM-1を産生する緑膿菌は本邦では分離されていません。 4.NDM-1遺伝子が大腸菌や肺炎桿菌から検出されていることが問題です。 今回のNDM-1産生菌報道においてもっとも重要なポイントは、この酵素を産生する菌が大腸菌や肺炎桿菌から分離されている点です。これまでもメタロβラクタマーゼを産生する菌が分離されていたことは上述した通りですが、それは主に緑膿菌やアシネトバクターなどの日和見細菌に認められていました。大腸菌や肺炎桿菌はこれら日和見細菌に比べ病原性が高く、市中の免疫能が保たれた患者の感染症の起因菌としてしばしば分離されます。また、大腸菌や肺炎桿菌は腸内細菌としてヒトの腸管内に常在している細菌です。このような事実から、NDM-1産生菌が院内だけでなく、市中感染として蔓延していくことが危惧されています。腸内細菌におけるNDM-1産生菌の出現が、自然界におけるメタロβラクタマーゼ遺伝子の蔓延のきっかけになるのではないかと心配されているのです。 5.NDM-1産生菌に感染した人の死亡率が高い訳ではありません。 NDM-1産生菌の病原性が通常の菌に比べて明らかに高いという報告は現時点ではありません。“スーパー細菌”という表現がみられますが、NDM-1遺伝子の存在は薬剤耐性に関して多剤耐性という特徴を付与しますが、基本的に病原性を変えるものではありません。しかも、感染する人の多くが健常人であり、宿主の感染防御能が保たれていることも幸いします。ただし、免疫不全宿主にNDM-1産生菌が感染した場合には、日和見感染症の1つとして治療に抵抗性を示す可能性は高まります。また、NDM-1遺伝子がサルモネラ菌や赤痢菌などのより病原性が強い菌に伝播・蔓延した場合には、重症・難治例が増加するのではないかと危惧されています。 6.NDM-1産生菌の検出には注意する必要があります。 前述したように、NDM-1はメタロβラクタマーゼの1つです。通常、メタロβラクタマーゼの検出にはSMA試験(メルカプト酢酸ナトリウムによるメタロβラクタマーゼの阻害)が用いられます。しかし、まだ理由は良く分かっていませんが、NDM-1産生菌ではSMA試験が陰性になる可能性が指摘されています。したがって、大腸菌や肺炎桿菌などの腸内細菌科でカルバペネム剤に耐性を示す株が分離された場合には、たとえSMA試験が陰性であっても、NDM-1産生の可能性を考えて対応することが重要です。NDM-1産生菌かどうかの最終的な確認のためには専門施設での遺伝子検査が必要になります。 7.NDM-1産生菌に対してはコリスチン・チゲサイクリンの抗菌活性が強いです。 これまでに分離されたほとんどのNDM-1産生菌は、他の耐性遺伝子を同時に保有することでカルバペネム剤を含む全てのβラクタム剤に耐性であるとともに、アミノグリコシド剤やフルオロキノロン剤に対しても同時に耐性を示すことが報告されています。前述したように、NDM-1産生菌による感染症の多くが健常人における市中感染としてみられることから、中等度耐性程度の薬剤であっても臨床効果が期待できる可能性があります。分離された菌の抗菌薬感受性をみながら、併用療法などを考慮することも重要です。これまでに報告されたNDM-1産生株の薬剤感受性成績からは、本邦では未承認のコリスチンやチゲサイクリンの強い抗菌活性が確認されています。 8.インド・パキスタン・バングラデッシュなどからの帰国者には注意する必要があります。 前述したように、NDM-1産生菌の多くは大腸菌や肺炎桿菌です。こられの細菌は腸内の常在細菌叢を形成する細菌であり、知らず知らずのうちに宿主の腸管内に紛れて国内に持ち込まれる可能性があります。インド・パキスタン・バングラデッシュなどの流行地からの帰国者は、NDM-1産生菌を腸管内に保菌している可能性も考えておく必要があります。腸管内のNDM-1産生菌がすぐに感染症の原因にはなりませんが、糞便などを介して本菌が伝播される可能性はあります。NDM-1産生菌に対する院内感染対策として特別なものはありません。手洗いや手袋の適切な使用など標準予防策の徹底がもっとも重要であり、もしNDM-1産生菌が分離された場合には他の多剤耐性菌と同様に接触感染予防策の対象となります。 9.NDM-1産生菌のサーベイランスが必要です。 現時点での本邦におけるNDM-1産生菌の分離は1例のみです(2010年9月8日現在)。しかし、前述したように、NDM-1産生株が人の腸管内に潜在してすでに多数持ち込まれている可能性も否定できません。NDM-1産生株の分離頻度がこれからどのように推移していくのか、他の細菌へのNDM-1遺伝子の蔓延が進行しないか、施設・地域そして全国規模の耐性菌サーベイランスを強化・徹底していくことが重要になると思われます。 2010年9月8日 多剤耐性菌院内感染対策ワーキンググループ 賀来 満夫 舘田 一博 |
|
多剤耐性アシネトバクター感染症に関する
四学会からの提言 はじめに 近年、多剤耐性アシネトバクターによる院内感染事例が我が国でも散発的に発生し、2010年9月には大学病院での事例が各種報道でも大きく取り上げられました。さらにNDM-1産生菌に代表される新しい耐性菌の本邦における検出例も報告され、日本中がその動向を注目している状況です。このような中で、感染症にかかわる各学会は、それぞれの特性を生かした提言やコメントを発信してまいりました。このたび、感染症関連の四学会(社団法人日本感染症学会、社団法人日本化学療法学会、日本環境感染学会、日本臨床微生物学会)は、我が国における多剤耐性アシネトバクター感染症の感染拡大防止、適正な診断と治療を促進することを目的に、現時点における問題点、将来に向けた改善点を提言としてまとめました。 提言 1.多剤耐性の定義を決める必要があります 本菌感染症の発症状況を正確に把握するためにも、アシネトバクター属細菌における多剤耐性の定義を早急に決める必要があります。米国臨床・検査標準協会(Clinical and Laboratory Standards Institute, CLSI)や欧州抗菌薬感受性試験法検討委員会(The European Committee on Antimicrobial Susceptibility Testing, EUCAST)が耐性菌のブレイクポイントを設定中ですが、本邦の耐性菌の頻度あるいは使用抗菌薬などを参考に独自の基準を考えながら、欧米との協調を探っていく必要があります。特に本菌をいわゆる5類感染症として定点把握の対象とするためには行政主導、あるいは行政との連携による定義の設定が不可欠です。 2.効果的なサーベイランスの実施とその活用が急務です これまでにも感染症の疫学調査が多く実施されてきました。これらの成績の中には極めて重要な情報が多数含まれているものと考えられますが、その活用、臨床現場へのフィードバックに関しては、必ずしも効果的な仕組みが出来上がっているとは言えない状況です。アシネトバクターを含め、全国レベル・地域レベルでの耐性菌の分離頻度、耐性状況などの情報を、施設レベルでの耐性菌対策に活かす方法を工夫していく必要があります。この点に関して、学会と行政のさらなる連携・協力が重要かと思われます。 3.現在進行形の症例に役立つサーベイランス体制を促進する必要があります 現在のところ、本邦における多剤耐性アシネトバクターの分離頻度は極めて低い状況にあります。したがって、1施設で短期間の間に2症例から本菌が分離された場合には院内伝播を考えて対応することが必要になります。現在進行形の症例に対して役に立つ施設内サーベイランスをどのように実施していくかについては、感染制御部(感染対策室)、診療担当医と微生物検査室との連携が極めて重要になります。また地域における発生動向などの情報共有には、行政との協力が欠かせません。 4.多剤耐性菌検査が実施できる環境整備が必要です 前述の現在進行形の症例に役立つサーベイランスを実現するためには、各医療施設における微生物検査室の設置が前提となります。現在、専門的な微生物検査・耐性菌検査を担当できる臨床検査技師の育成が認定臨床微生物検査技師制度、あるいは感染制御認定臨床微生物検査技師制度を通して行われています。これら人材の協力のもとに、効果的な院内感染対策・耐性菌対策をサポートできる微生物検査室環境の整備と充実が重要と考えます。また、微生物検査室において新たな多剤耐性菌を検出するためには追加検査を必要とすることが多く、体外診断薬メーカーによる検査試薬の開発と供給や、診療報酬点数の加算など行政的なサポートが必須となります。 5.感染対策への十分な財政的支援が必要です 多剤耐性アシネトバクターが分離された患者に対して、医療機関では標準予防策に加え接触感染予防策を徹底し他患者への伝播を防止する必要があります。そのためには患者を個室に配置し、医療従事者が入室のたびに使い捨て手袋やガウン・エプロンを使用しなければなりません。これらの感染防護具は「疾患の予防」の範疇になるため、診療報酬で全く手当されず、厳格な感染対策を取れば取るほど病院経営に悪影響を及ぼすのが現状です。効果的な感染対策を講じることができる体制をととのえるためにも、正当な感染対策に関する診療報酬上の評価が必須と考えます。 6.感染症診療、感染対策に従事する人材の配置と育成が重要です 多剤耐性アシネトバクター感染症の集団発生の防止や、万一発生した場合の原因調査や再発防止策を講じ、さらに適正な診療を実施するにはこの領域の専門家が少なくとも地域の基幹医療機関には配置されていることが必要です。大学病院などの高度な医療を提供する特定機能病院や臨床研修指定病院においては複数の専従者が必要です。単位ベッドあたりの専従・専任者を十分に配置し、効果的な医療関連感染防止を実施できれば、医療関連感染を減少させ無駄な医療費を削減することができます。これらを実現するためには、感染症や感染対策の専門家の育成、システム構築のための制度改善、診療報酬の見直しなど、行政との連携した対応が重要と考えます。 7.未承認薬の早期承認が望まれます 多剤耐性アシネトバクター感染症に対する治療薬として、国内未承認であるコリスチンやチゲサイクリンが注目を集めています。欧米では第一選択薬となっているような薬剤がなぜ本邦で使用できないのか、その早期承認に向けた関係学会と行政の連携が強く望まれています。また、これら薬剤の適正使用、副作用発現の抑制、耐性菌出現防止対策などの視点から、多剤耐性菌感染症に対する治療ガイドラインの作成などを推進していくことが必要です。 8.新しい治療薬の研究開発を促進する仕組み作りが必要です いかに適正使用を心がけても、早晩コリスチンやチゲサイクリンに対しても耐性菌の出現がみられることは予想されるところです。耐性菌感染症を増加させない体制作りとともに、新しい治療薬の開発・研究の促進は極めて重要な課題と思われます。しかし実際には、研究開発費と収益性の視点を含め、製薬企業にとって新しい感染症治療薬の開発に積極的に参入できる環境が整っているとは言えない状況があります。関係学会と行政は、“耐性菌感染症に対する新しい治療薬の開発”という大義に基づき、製薬企業が新薬開発に参入・継続できる仕組みを中・長期的な視点で考えていくことが必要と考えます。 2010年10月21日 社団法人日本感染症学会 理事長 岩本 愛吉 社団法人日本化学療法学会 理事長 松本 哲朗 日本環境感染学会 理事長 小西 敏郎 日本臨床微生物学会 理事長 戸塚 恭一 |